Enzimologia
Prof. André Ferraz
Essa página está sendo preparada
em caráter experimental. Ela é um roteiro de estudos para parte da disciplina
"Enzimologia". Estamos fazendo uso da INTERNET para facilitar ao aluno
a busca de informações sobre a disciplina, bem como para direcionar o estudo
aos tópicos de interesse e para deixar questões abertas à discussão em sala de
aula. No segundo semestre de 2002, vários alunos que cursaram a disciplina,
opinaram favoravelmente ao uso da internet para antecipar informações que serão
apresentadas e discutidas em sala de aula. No entanto, tenha claro que a
consulta a esse roteiro não substitui a necessidade
de busca de informações na bibliografia recomendada.
Como
ocorre com todas as páginas da WEB, estaremos constantemente atualizando as
informações disponíveis. Por isso, mande críticas, sugestões e correções para aferraz@debiq.eel.usp.br.
Bom
proveito e estude com dedicação,
André
Ferraz
Página atualizada em 19/01/2010
(Se ao selecionar um link não observar a figura, tente atualizar a
página através de seu navegador de internet)
Aspectos formais da disciplina
Verifique aqui o cronograma de
execução da disciplina em 2010
Conteúdo
da disciplina e sistema interativo de informações
1. A origem das enzimas (funções bioquímicas e organelas
celulares)
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() meio
extracelular
meio
extracelular
![]()
 membrana celular
membrana celular
![]() meio
intracelular
meio
intracelular
Representação de
uma célula
- A célula, para sobreviver, capta substâncias no
meio extracelular, as transporta para seu interior (através da membrana
semipermeável) e as transforma em moléculas úteis ao metabolismo.
- Grande parte das transformações realizadas pela
célula é catalisada por enzimas. Há situações em que transformações extracelulares também são
catalisadas por enzimas (enzimas produzidas dentro da célula e secretadas no
meio extracelular). Estas transformações extracelulares usualmente são
necessárias quando a substância alvo é muito grande (massa molar elevada) para
permear a membrana celular.
- Pode-se então dividir as enzimas em intracelulares e extracelulares.
Essa
disciplina abordará como essas enzimas atuam, como podem ser obtidas e
purificadas e quais suas aplicações tecnológicas. A parte teórica compreenderá,
além de uma breve revisão sobre a estrutura e as propriedades das enzimas, a
apresentação de conceitos e métodos experimentais que darão suporte à execução
das aulas práticas previstas para o curso.
1.1.
O mercado mundial de enzimas
Bibliografia
recomendada:
Industrial Enzimology,
Godfrey T. e West S (eds), 1996, Cap 1
- Antes de iniciar o estudo das enzimas, vale ao
Engenheiro ter em mente a magnitude do mercado mundial
de enzimas e suas perspectivas de crescimento.
- Usualmente a
produção de enzimas é avaliada pelo montante de vendas e não pela quantidade
produzida. Primeiro porque há grande disparidade de preços entre as enzimas,
onde enzimas de uso massivo custam pouco e se contrapõem às enzimas de uso
analítico ou farmacêutico que são produzidas em menor escala, porém
comercializadas a preços mais elevados. Segundo porque, como veremos mais
adiante nesse curso, as enzimas são quantificadas pela atividade enzimática de
seus preparados e não em kg ou qualquer outra unidade de massa.
- Outro
aspecto relevante é a distribuição de mercado dessas
enzimas de acordo com suas aplicações. Trata-se de um mercado que
inicialmente dependia basicamente da demanda dos setores alimentícios e de
detergentes. No entanto, a tendência atual é o surgimento
de novos setores usuários e em processos cada vez mais específicos.
- Em sua
maioria, as enzimas produzidas industrialmente são de natureza hidrolítica
(cerca de 75% em 1994).
- Entre as
enzimas hidrolíticas de maior mercado, estão as proteases (usadas como
coagulantes na indústria de laticínios e na indústria de detergentes) e as
lipases (usadas na indústria de detergentes). Um segundo grupo de enzimas
hidrolíticas compreende as carbohidrases usadas na despolimerização de
polissacarídeos nas indústrias de panificação, de cerveja, de amido e de
produtos têxteis.
- O mercado de
enzimas atual está se diversificando. As enzimas destinadas a produção de
“especialidades” passaram a apresentar destaque representando cerca de 50% do
mercado, com ênfase para enzimas usadas na indústria da biotrasformação
(fármacos, principalmente) e nos kits de diagnóstico (enzimas com fins
analíticos).
- A
implantação de programas de produção de etanol combustível a partir de amido de
milho na América do Norte dará ainda mais importância ao uso de amilases que se
destinam a hidrólise do amido até glicose.
- No mesmo
sentido, a implantação iminente do programa de geração de etanol combustível a
partir de materiais lignocelulósicos na América do Norte e Europa, além do Brasil
deve alterar a distribuição atual dos setores de enzimas no mercado, pois o uso
de celulases para a hidrólise enzimática de biomassa passará a ter grande
relevância dentro do mercado mundial.
- Ainda antes
de discutirmos em detalhes a obtenção, a ação e as aplicações de enzimas de
interesse tecnológico, vale lembrar que os produtos comerciais a base de
enzimas são efetivamente formulações complexas que têm as enzimas como agente
ativo. Porém, essas formulações agregam vários
aditivos com finalidades de diluição, estabilização e preservação das enzimas.
Páginas web de interesse sobre mercado de enzimas e
empresas produtoras:
www.novozymes.com (NOVOZYMES - Maior empresa produtora de enzimas no
mundo)
www.genencor.com (Genencor - Segunda maior empresa
produtora de enzimas no mundo)
www.amano-enzyme.co.jp/english
(Amano - Lider Japonesa na produção de enzimas)
www.novozymes.com.br
(NOVOZYMES no Brasil – Auraucária, PR)
www.iogen.ca
(IOGEN – empresa Canadense com atuação na prod de celulases para o processo Etanol
de biomassa)
Faça também uma busca na internet sobre
"world enzyme market" e veja o que há de novo nesse tema
Veja ainda:
Schmid A., Dordick J.S., Hauer B., Kiener A., Wubbolts M. and Witholt B.
(2001) Industrial biocatalysis today and tomorrow. Nature 409, 258-268
(Artigo de revisão sobre desenvolvimentos relativamente recentes envolvendo a
aplicação biocatalítica de enzimas e células inteiras e suas implicações para a
indústria química)
2.
Estrutura e propriedades das enzimas
Bibliografia
recomendada:
Biotecnologia
Industrial, Almeida Lima et al., vol 3; 2001, Cap. 14, itens 14.1 e 14.2 e/ou;
Biotecnologia,
Scriban R., 1985, Parte 3, Cap 1, itens 1.1 e 1.2 e/ou;
Bioquímica,
Lehninger et al. 1976, vol 1, Cap 5,6, 8 e 9
- Enzimas são catalisadores, e portanto, atuam no
sentido de diminuir a energia de ativação de determinada
reação.
Pode-se
representar a reação como segue:
E + S D ES D EP D E + P
, onde:
E =
enzima; S = substrato; P = produto
- O que diferencia as enzimas dos catalisadores
inorgânicos, é que as enzimas são proteínas e têm sua atividade determinada
pelas características estruturais da proteína.
Aqui se faz
necessário recapitular alguns conceitos básicos da química de proteínas
(abordados nas disciplinas anteriores de bioquímica)
Bibliografia
recomendada:
Bioquímica,
Lehninger et al., 1976, vol 1, Cap 5 e 6 e/ou;
Biotecnologia
Industrial, Almeida Lima et al. 2001, vol 3; Cap. 14, itens 14.1 e 14.2.
Biotecnologia,
Scriban R., 1985, Parte 3, Cap 2 e/ou;
Biochemistry, Voet D e Voet
JG, 1995, Cap 3.
Estrutura
primária: é determinada pela seqüência
de aminoácidos que ocorrem na molécula protéica.
Estrutura
secundária: As ligações C-N nas amidas (que compõem o
polipeptídeo) possuem um certo caráter de dupla ligação C-N. Isso restringe o movimento giratório das ligações peptídicas e usualmente
dá origem a estruturas não lineares. Uma configuração característica que ocorre
nos polipeptídeos é a alfa-hélice que é observada na
queratina. Nessa proteína há pontes de hidrogênio
entre o H ligado ao N da ligação peptídica e o O carbonílico do terceiro
aminoácido adjacente.
Estrutura
terciária: As
estruturas terciárias são observadas nas proteínas globulares e dependem,
basicamente de torções ao longo da cadeia peptídica que levam a formar estruturas enoveladas.
- A estrutura
terciária é muito importante para as proteínas com capacidade catalítica (enzimas), pois muitas
vezes o sítio ativo da enzima ocorre no interior desse "novelo" e
comumente permite um "acesso" restrito, habilitado somente para
alguns tipos de moléculas.
Estrutura
quaternária: resulta da interação de várias cadeias
polipeptídicas devido a interações físicas (como ponte de hidrogênio) ou mesmo
ligações covalentes, como as pontes de dissulfeto intercadeia.
- A ação catalítica da
quimotripsina (uma enzima proteolítica, ou uma protease) é um exemplo
ilustrativo de como a reação depende da estrutura tridimensional
da enzima. Note que é necessário que os aminoácidos de número 57 (His) e 195
(Ser) estejam espacialmente próximos para que a enzima possa realizar a
hidrólise de uma ligação peptídica.
Pense: Como seria a correspondente hidrólise de uma
ligação peptídica catalisada por ácidos e não por enzimas. Consulte um livro de
química orgânica se necessário. Faça um contraponto entre os dois tipos de
reação.
- O
conhecimento da estrutura das enzimas é crítico, pois dessa estrutura depende a
atividade catalítica. Como é possível imaginar, essa estrutura, mantida basicamente
por interações do tipo ponte de hidrogênio e forças de Van der Waals, pode
facilmente ser perdida dependendo do meio ao qual a enzima está sujeita.
- Em geral
pode-se observar que embora as enzimas sejam catalisadores muito eficientes,
elas são menos resistentes a condições severas de reação quando comparadas com
os catalisadores inorgânicos. Ou seja, qualquer agente externo que possa
interferir no arranjo estrutural, pode desnaturar a enzima e torná-la inativa.
Entre esses agentes externos cabe ressaltar o efeito marcante do: pH; da temperatura e; da força iônica e natureza do
solvente.
Pense: O equilíbrio químico ácido-base correspondente
às funções nitrogenadas, ácidos carboxílicos e álcoois é fundamental para
entender as faixas ideais de funcionamento de um sítio catalítico de uma
enzima.
Como o pH pode afetar a ação catalítica?
Equilíbrio ácido-base em grupos
Nitrogenados:
exemplo com íon amônio NH4+ + H2O D NH3 + H3O+
Equilíbrio ácido-base em grupos
carboxílicos:
-COOH
+ H2O D -COO- + H3O+
Equilíbrio ácido-base em grupos álcoois
R-OH
+ H3O+ D R-OH2+ + H2O
Obviamente, todos esses equilíbrios
dependem do pH. Ou seja, o equilíbrio será deslocado para um dos lados
dependendo do pH da solução. O que define a população de cada espécie em água é
a constante de equilíbrio, ou os respectivos pKas ou pKbs.
Considerando que o pKa do grupo
nitrogenado da histidina 57 na quimotripsina é igual a 6,0, o que você
esperaria para a atividade catalítica estudada anteriormente em pH 4,0 e pH 7,0?
Pense: Exemplo complementar: Lisozima
2.1
– Especificidade das enzimas para o substrato
- As enzimas
podem apresentar especificidade diferenciada frente aos seus substratos.
- Há enzimas
extremamente específicas, que podem, por exemplo, diferenciar isômeros de um
mesmo substrato. Por exemplo, a aspartase catalisa a reação
(reversível) de adição de amônia ao fumarato, produzindo o L-aspartato. A
especificidade nesse caso é tão grande que o isômero cis do fumarato (o
maleato) não pode sofrer a adição de amônia, nem o D-aspartato pode ser
desaminado pela enzima.
- A
especificidade de uma enzima pelo substrato pode existir, pois deve haver uma complementaridade entre as estruturas do substrato e a
do sítio ativo da enzima, ou seja, o substrato deve acoplar-se de uma única
forma ao sítio ativo e então dar início à reação catalítica. Algumas enzimas
podem reconhecer isômeros óticos de um mesmo substrato ou até mesmo centros pró-quirais de um determinado substrato.
- Por outro
lado, há enzimas menos específicas que podem atuar sobre uma diversidade maior
de substratos. Em geral, essas enzimas apresentam o sítio catalítico (ou sítio
ativo) relativamente desimpedido. Entre essas enzimas destacam-se as
oxido-redutases.
3.
Purificação de enzimas
3.1.
Fontes de enzimas de interesse tecnológico
Bibliografia
recomendada:
Biotecnologia
Industrial, Almeida Lima et al. 2001, vol 3; Cap. 14-16 e/ou;
Industrial
Enzimology, Godfrey T. e West S (eds), 1996, Cap 1 e/ou;
Biotecnologia,
Scriban R., 1985, Parte 3, Cap 2.
Enzimas
de origem microbiana
- A grande
maioria das enzimas utilizadas industrialmente é produzida a partir de
microrganismos, através de processos fermentativos. As enzimas de origem
microbiana representam cerca de 90% do mercado, excluindo-se aqui as enzimas
contidas nos cereais malteados (origem vegetal) que, por serem usadas in
situ, não são primariamente consideradas como enzimas industriais.
- O processo de produção industrial de enzimas de origem
microbiana, pode ser dividido em duas etapas:
1) Processo fermentativo (tema de outras disciplinas desse curso)
2) Processo de separação e recuperação das enzimas a partir da
fermentação
veja
nesse link, como as empresas informam seus processos: Novozymes
- O processo
de separação e recuperação depende inicialmente do tipo de enzima de interesse,
intracelular ou extracelular. No caso das enzimas extracelulares, o processo de
recuperação tem início no líquido fermentado ou no caso de fermentações em meio
sólido, no líquido de extração do substrato. No caso das enzimas intracelulares
é necessário aplicar algum método prévio de ruptura celular a fim de liberar as
enzimas.
- Em todas as
etapas de separação e recuperação das enzimas é necessário manter condições não
desnaturantes, isto é, condições nas quais as enzimas não perderão atividade.
- Em geral o
material fermentado (ou o extrato de
fermentações em meio sólido) segue as seguintes etapas de tratamento:
1) Separação sólido-líquido para remoção das células do
microrganismo envolvido
2)
Refrigeração até cerca de 5ºC (manutenção de temperatura adequada para
preservar a atividade das enzimas)
3)
Concentração da solução, quer por evaporação a vácuo ou ultrafiltração
através de membranas que permitem a passagem de solução de compostos de baixa
massa molar e conseqüente retenção da(s) enzima(s) de interesse.
4) Etapas
de purificação adicionais nos casos onde o produto comercial é fornecido com
elevado grau de pureza.
5)
Secagem em condições não desnaturantes nos casos de produtos comercializados
como pó.
No caso das
enzimas de interesse serem intracelulares, há demanda por
operações unitárias adicionais:
1) Após a
separação sólido-líquido mencionada anteriormente, as células são recuperadas
2) Uso de
algum processo de ruptura celular. Industrialmente os processos mais aplicados
são a moagem em moinhos de bolas de vidro e a ruptura sob alta pressão (de
fato, extrusão de uma suspensão de células). Ultra-som, digestão alcalina e
digestão enzimática, também são aplicáveis, mas industrialmente não têm obtido
êxito.
3) Nova
separação sólido-líquido a fim de eliminar os fragmentos de célula insolúveis
4) O
sobrenadante pode ser processado como o caldo fermentado, porém é comum a
demanda por algumas etapas de purificação adicional a fim de eliminar outros
constituintes intracelulares presentes. Principalmente a aplicação de alguma
técnica de precipitação seletiva de ácidos nucléicos.
- Em todos
os casos de separação e recuperação das enzimas, processos adicionais de
purificação podem ser aplicados a fim de preparar um produto com maior grau de
pureza. As técnicas empregadas, bem como suas vantagens e limitações serão
discutidas mais adiante nesse curso.
Enzimas de origem vegetal
- As enzimas
de origem vegetal que têm encontrado maior aplicação industrial são, de fato,
misturas de proteases usadas na indústria de alimentos, principalmente no
amaciamento de carnes e clarificação de cervejas. Essas proteases são obtidas
principalmente do látex oriundo de frutos verde do mamoeiro papaia (Carica
papaya) e abacaxi (Ananas comosus).
- As proteases
do mamão são comumente chamadas de papaína e as do abacaxi de bromelina
- Essas
enzimas são comumente comercializadas como extratos brutos, concentrados ou
mesmo secos a vácuo. Várias etapas de purificação dessas enzimas são possíveis
e discutidas mais adiante.
- Um grupo variado
de outras enzimas de origem vegetal tem sido estudado e suas obtenções e
aplicações comerciais ainda não estão amplamente estabelecidas. Há uma série de
limitações com relação a manutenção da qualidade de enzimas de origem vegetal,
especialmente nos extratos brutos, visto a grande diversidade de tipos de
planta e estado de maturação dos frutos ou tecidos que darão origem às enzimas.
-
Um excelente compêndio sobre enzimas de origens variadas, bem como suas
aplicações, é mostrado em dois anexos do livro "Industrial Enzimology,
Godfrey T e West S, 1996, Data index 3 e 4".
- Um grupo
adicional de enzimas de origem vegetal corresponde às amilases presentes nos
cereais submetidos à produção de malte. De fato essas
enzimas são comercializadas de forma diretamente retida no interior dos grãos
de cereais que passaram pelo processo de malteação e são quase que
exclusivamente usadas na produção de cervejas. Como essas enzimas são
comercializadas retidas nos próprios grãos dos cereais, normalmente são
excluídas nos cômputos das enzimas de interesse industrial.
Enzimas de origem animal
- Como no caso
das enzimas de origem vegetal, boa parte das enzimas de origem animal
corresponde a proteases, apesar de algumas lipases e amilases também serem
encontradas na mistura denominada de pancreatina (oriunda de tecidos do
pâncreas suíno).
- Entre as
enzimas de origem animal com aplicação comercial ainda se destacam a pepsina e
a renina (proteases).
- A obtenção
dessas enzimas passa geralmente pela maceração do tecido onde são produzidas no
animal (geralmente órgãos como o estômago ou o pâncreas), seguida da extração
com soluções tampão apropriadas. A suspensão preparada é então submetida a um
processo de separação sólido-líquido e processada de forma similar ao descrito
para as enzimas de origem microbiana.
3.2 – Técnicas de purificação de enzimas
Bibliografia
recomendada:
Bioquímica,
Lehninger et al., 1976, vol 1, Cap 7 e/ou;
Biotecnologia
Industrial, Almeida Lima et al. 2001, vol 3; Cap. 17 e/ou;.
Biochemistry, Voet D e Voet
JG, 1995, Cap 5.
- As técnicas
de purificação de enzimas, de fato, são comuns às de todas as demais proteínas.
No caso específico das enzimas, é fundamental considerar que qualquer técnica
de purificação empregada deve, além de permitir recuperar a proteína numa forma
mais pura, deve também proporcionar a obtenção da proteína na forma ativa. Em
outras palavras, a enzima não pode perder sua atividade.
- Os diferentes procedimentos empregados na purificação
das enzimas podem se agrupados com base na característica da proteína que serve
como base para a separação:
Característica
da Proteína Procedimento de separação
Solubilidade 1.
Precipitação por salificação
2.
Precipitação isoelétrica
3. Precipitação por
solventes
Carga 1.
Cromatografia de troca iônica
2.
Eletroforese
3.
Focalização isoelétrica / Precipitação isoelétrica
Polaridade 1.
Cromatografia de adsorção
2.
Cromatografia em papel
3.
Cromatografia em fase reversa
Tamanho 1.
Diálise e ultrafiltração
2.
Cromatografia de permeação em gel
3.
Eletroforese em gel
4.
Ultracentrifugação
Especificidade 1.
Cromatografia de afinidade
- Nesse tópico iremos apresentar e discutir alguns
desses procedimentos
Procedimentos de purificação baseados na solubilidade
A)
Precipitação por salificação ("salting out") – Efeitos da
concentração de sais sobre a solubilidade
- A
solubilidade de uma enzima em uma solução aquosa depende da força iônica* dessa
solução. Um pequeno aumento da força iônica leva a um aumento na solubilidade.
No entanto, forças iônicas maiores que 1,2-2, geralmente
proporcionam uma diminuição considerável da solubilidade das proteínas. Esse
fenômeno é a base dos procedimentos de precipitação por salificação.
____________
Revisão* A força iônica de uma solução é definida como: I = ½ S Ci x Zi2
onde: Ci
= concentração molar de cada íon em solução
Zi
= carga da cada íon em solução
Por exemplo: Força iônica de uma solução
1,5 M de (NH4)2SO4:
1 mol de (NH4)2SO4
em solução gera 2 moles de NH4+ e 1 mol de SO42-
Então: I = ½ x (1,5x2x12 +
1,5x1x22) = 4,5
Como
exercício, re-estruture a figura que apresentamos anteriormente (mostrando a
solubilidade de proteínas em função da força iônica) usando agora concentração
de sulfato de amônio no lugar da força iônica.
_____________
-
Obviamente, a solubilidade da enzima é dependente de sua estrutura e o efeito
da força iônica sobre a solubilidade varia de uma enzima para outra.
- O
aumento da força iônica da solução aquosa pode ser obtido pela adição de sais a
essa solução. Vários sais podem ser empregados. Para processos de purificação
em escala ampliada, o custo e a pureza do sal empregado passa a ser de grande
importância. Um dos sais mais empregados para esse fim é o sulfato de amônio
que possui uma solubilidade elevada em água (aproximadamente 3,9 mol/L).
B)
Precipitação isoelétrica – Efeitos do pH sobre a solubilidade
- O pH também exerce efeito
marcante sobre a solubilidade das enzimas. Geralmente, a solubilidade da
enzima é mínima no pH isoelétrico* (ou ponto isoelétrico).
___________
Revisão* pH isoelétrico é o pH no qual a proteína não apresenta carga
efetiva. Lembre que numa proteína, há grupos funcionais dos aminoácidos que
podem estar carregados dependendo do pH. Grupos amino podem estar protonados em
pH ácido e grupos carboxílicos podem estar desprotonados em pH alcalino.
Obviamente esse equilíbrio depende do pKa/pKb de cada grupo envolvido.
- O pI de uma enzima depende, portanto, de sua composição de aminoácidos.
_____________________
C)
Precipitação por adição de solventes – Efeitos da constante dielétrica da
solução sobre a solubilidade
- A uma
dada força iônica e pH, a solubilidade das enzimas é proporcional a constante
dielétrica da solução. Esse fato permite precipitar proteínas contidas em
solução aquosa pela adição de solventes de constante dielétricas menores que a
da água. Em geral, etanol e acetona são usados para essa finalidade. A
constante dielétrica desses solventes é 24 e 21, respectivamente, enquanto a da
água é 80. Usualmente a adição de um igual volume de etanol a uma solução
aquosa da enzima (resultando numa solução com 50% de etanol) é suficiente para
precipitá-la.
- Um
aspecto limitante dessa técnica é que algumas enzimas são desnaturadas pela
adição do solvente, especialmente se a temperatura da mistura não é mantida em
valores o mais próximo de 0ºC possível.
Em todos os procedimentos
descritos anteriormente (A-C) a enzima é separada
da solução por precipitação. Uma etapa posterior de purificação é, portanto, a
separação do sólido precipitado do líquido remanescente. Essa separação pode
ser feita simplesmente por filtração e mais comumente por centrifugação se a
quantidade de sólido precipitado é pequena ou se a enzima pode ser perdida por
adsorção no meio filtrante.
Todos os procedimentos descritos anteriormente são usualmente realizados
a baixas temperaturas para minimizar as possibilidades de desnaturação da
enzima e a conseqüente perda de atividade. A faixa ideal de temperatura para
essas operações (incluindo a centrifugação e a filtração) é de 0-5ºC.
Procedimentos de purificação baseados na carga
- A carga efetiva de uma proteína depende do pH,
como já mencionado anteriormente. Os procedimentos de purificação baseados na
carga são, portanto, diretamente dependentes do pH.
- Uma visão mais clara sobre o efeito do pH na carga
efetiva de uma proteína pode ser observado pela avaliação de sua curva de titulação. O entendimento dessas curvas de
titulação é muito importante para definir o tipo de método a ser empregado na
purificação de determinada enzima quando se usa um procedimento baseado na
carga.
A)
Cromatografia de troca iônica
- A
cromatografia de troca iônica é amplamente empregada para a purificação de
enzimas. As colunas cromatográficas mais utilizadas empregam fases estacionárias que são derivados de celulose:
DEAE-celulose
(dietilaminoetilcelulose) a pH 7,0
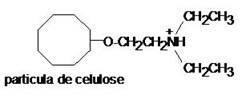
- A
DEAE-celulose funciona como uma resina trocadora de ânions e, portanto, é
aplicável na purificação de enzimas com carga efetiva negativa.
CM-celulose
(carboximetilcelulose) a pH 7,0

- A
CM-celulose funciona como uma resina trocadora de cátions e, portanto, é
aplicável na purificação de enzimas com carga efetiva positiva.
-
No procedimento cromatográfico, uma mistura de proteínas é aplicada na coluna
que em seguida é eluída com uma solução de pH pré-definido.
A definição do pH é feita como
segue:
- acima do pI para a proteína
de interesse, quando se usa uma coluna trocadora de ânions
- abaixo do pI para a
proteína de interesse, quando se usa uma coluna trocadora de cátions
- Nas condições definidas acima,
a enzima apresentará forte interação eletrostática com a fase estacionária da
coluna. Freqüentemente a coluna é percolada com um gradiente salino (e não de
pH) a fim de, paulatinamente, aumentar a interação enzima-solvente e então
permitir que a enzima seja eluída da coluna.
- Algumas fases estacionárias
utilizadas em cromatografia de troca iônica associam a separação por troca
iônica com a separação por tamanho (abordado mais a frente). Nesses casos a
eficiência de separação é ainda maior, pois, por exemplo, proteínas com
características eletrostáticas semelhantes, porém com tamanhos diferentes podem
ser separadas eficientemente.
B) Eletroforese e
eletrofocalização
- Essas duas técnicas se baseiam
na mobilidade de uma proteína quando submetida a um campo elétrico. As técnicas
eletroforéticas são muito empregadas na caracterização analítica de proteínas,
mas raramente são usadas na purificação preparativa.
Procedimentos de purificação baseados no tamanho
A)
Diálise e ultrafiltração
- A diálise é uma das
técnicas mais simples de purificação baseada no tamanho. Basicamente se utiliza
uma membrana semipermeável para reter moléculas protéicas permitindo a passagem
das moléculas menores do soluto e da água.
- Há membranas de cortes para massas molares variadas
que vão desde 1000 Da até 30 kDa ou mais.
- A diálise é usada freqüentemente após uma etapa de
precipitação com sulfato de amônio. Normalmente o precipitado carrega
quantidade significativa de sal (além da enzima) e requer a dessalinização por
diálise.
- A ultrafiltração está baseada num princípio semelhante ao da
diálise, ou seja, moléculas menores são separadas da solução contendo a enzima
de interesse, através da passagem por uma membrana semipermeável. Muitas vezes
a ultrafiltração é empregada e classificada como uma etapa de concentração, uma
vez que permite a retirada de grande quantidade de água além de solutos de
baixa massa molar.
- A força que impulsiona a solução de enzima sobre a
membrana semipermeável pode ser: pressão exercida por um gás (tipicamente
nitrogênio); força centrífuga ou ainda a filtração contra vácuo. Existem equipamentos específicos destinados a ultrafiltração
preparativa que operam por filtração contra vácuo e que associam ainda o uso da
circulação da solução contendo as enzimas sobre a membrana para minimizar a
obstrução da membrana.
B)
Cromatografia de permeação em gel
- Essa
técnica pode ser aplicada tanto com caráter preparativo como analítico (na
determinação de massa molar de enzimas). O princípio da técnica está baseado na
exclusão seletiva (por tamanho) de moléculas por um gel (Sephadex, Agarose e outros) de porosidade
conhecida.
- A
técnica comumente é usada através da permeação da mistura de enzimas em uma
coluna empacotada com o gel. Pode-se ainda usar o gel como agente de
concentração de soluções de proteínas, uma vez que seus poros podem reter água
e moléculas de baixa massa molar. Para isso se adiciona a solução com enzimas
sobre uma certa quantidade de gel seco.
- Uma
coluna cromatográfica empacotada com um gel de exclusão pode ainda ser calibrada com proteínas de massa molar conhecidas e
então usada como ferramenta analítica para a determinação de massas molares de
proteínas desconhecidas.
Procedimentos de purificação baseados na especificidade
Cromatografia
de afinidade
- Essa
técnica está baseada num procedimento de eluição da enzima em uma coluna que
tem ligado (covalentemente) à fase estacionária um
"pseudo-substrato", ou usualmente um co-fator da enzima. A enzima fica então "aderida" a esse substrato
e pode posteriormente ser eluída por um gradiente de força inônica ou por uma
alteração de pH.
3.3 Controle de etapas e estratégia experimental na
purificação de enzimas
- Os
procedimentos de purificação de enzimas devem ser monitorados pela determinação
da atividade enzimática (detalhes sobre a determinação da atividade serão discutidos
mais adiante nesse curso) após cada etapa. Um diagrama típico com os resultados
de um procedimento de purificação com etapas sucessivas é mostrado abaixo:
|
Etapa |
Volume da fração (mL) |
Proteína total (mg) |
Atividade enzimática total (IU) |
Atividade específica (IU/mg de
proteína) |
Razão de purificação (ativ. espec.
após purif./ ativ. espec. antes purif.) |
|
Extrato celular bruto |
1.400 |
10.000 |
100.000 |
10 |
1 |
|
Precipitação |
280 |
3.000 |
96.000 |
32 |
3,2 |
|
Cromatografia de troca iônica |
90 |
400 |
80.000 |
200 |
20 |
|
Cromatografia de permeação em gel |
80 |
100 |
60.000 |
600 |
60 |
|
Cromatografia de afinidade |
6 |
3 |
45.000 |
15.000 |
1500 |
- No quadro
apresentado anteriormente, há uma seqüência de procedimentos preparativos de
purificação que envolveu as seguintes etapas:
Precipitação
> Cromatografia de troca iônica > Cromatografia de permeação em gel >
Cromatografia de afinidade
-----------
Exemplo de purificação e recuperação:
Suponha
uma mistura de proteínas que contém uma enzima de interesse (volume inicial de
2L com 1000 mg de proteína total e 10.000 UI da enzima). A enzima de interesse
apresenta ponto isoelétrico igual a 8 e massa molar igual a 50 kDa. As demais
enzimas apresentam pontos isoelétricos menores que 8 e massas molares variando
entre 10 e 60 kDa (veja aqui uma eletroforese
bidimensional com informações sobre a mistura)
Estratégia
adequada de purificação:
|
Etapa |
Volume da fração (mL) |
Proteína total (mg) |
Atividade enzimática total (IU) |
Atividade específica (IU/mg de
proteína) |
Razão de purificação (ativ. espec.
após purif./ ativ. espec. antes purif.) |
|
Extrato bruto |
2.000 |
1.000 |
10.000 |
10 |
1 |
|
Ultrafiltração com corte de 20 kDa |
200 |
500 |
9.500 |
19 |
1,9 |
|
Cromatografia de troca
iônica em CMC a pH 6,5 e eluição com gradiente de NaCl |
20 |
200 |
9.200 |
46 |
4,6 |
Pense: O que
aconteceria se você, após a ultrafiltração, partisse para uma purificação por
exclusão molecular com um gel de fracionamento entre 20 e 100 kDa?
-----------
- A
definição da seqüência de etapas a ser utilizada é considerada como a
estratégia experimental de purificação. É obvio que muitas combinações podem
ser utilizadas e a decisão de utilizar uma seqüência ou outra depende de vários
fatores. Quanto maior for o conhecimento sobre as características da enzima
alvo, maiores as chances de definir uma estratégia eficiente de purificação.
Experimentalmente é comum se realizar uma seqüência inicialmente empírica a fim
de obter alguns parâmetros sobre a enzima desconhecida, como massa molar e
características ácido-base (determinação do ponto isoelétrico se possível).
- Em escala
de laboratório, usualmente o custo de cada etapa de purificação não é
determinante na escolha. Já em escala industrial, a purificação é realizada com
uma variável adicional que é o custo/benefício do procedimento. Ou seja, muitas
vezes se opta por um procedimento de menor custo, mesmo que em detrimento de
alguma eficiência.
Há um software disponível na internet que permite ao usuário avaliar
suas estratégias para purificar proteínas.
Esse software foi criado e
gentilmente disponibilizado pelo Prof. Andrews G. Booth (Protein Lab", by A.G. Booth, School of Biochemistry
and Biotechnology, University of Leeds, Leeds, United Kingdom)
Você pode realizar o download e
instalar em seu computador. O arquivo é pequeno e de fácil instalação e uso.
Procedimentos
1) Crie uma pasta específica no
seu microcomputador
2) Faça o download dos 5 arquivos
abaixo para a pasta recém criada
3) Através do explorador do
windows execute o aplicativo protlab.exe
Página principal referente ao software: www.bio-link.org/clearinghouse/protein.htm
Pratique
com o software. É interessante e lhe permitirá realizar muitos experimentos sem
sair da sua sala.
4. Conceito de unidade enzimática e atividade específica
Bibliografia
recomendada:
Bioquímica,
Lehninger et al., 1976, vol 1, Cap 8 e/ou;
Enzymes: a practical
introduction to structure, mechanism and data analysis, Copeland, R.A., 2000,
Cap. 5
- A
quantificação da atividade enzimática está intimamente ligada ao estudo da
cinética das reações catalisadas por enzimas.
- Até o
momento discutimos sobre a origem e as formas de obter enzimas de uma forma
relativamente purificada. Uma demanda imediata em todos os procedimentos
experimentais relacionados a esse tema é a determinação da atividade enzimática.
É necessário ter claro que determinar quanto há de uma determinada enzima em
uma solução é uma questão muito mais complexa que determinar, por exemplo,
quanto há de um determinado composto químico de baixa massa molar. Como temos
visto, uma enzima de interesse é produzida simultaneamente com outras enzimas,
além de uma infinidade de metabólitos não enzimáticos. Ou seja, determinar, por
exemplo, quanto há de proteína em uma solução não representa, de forma alguma,
quanto há da enzima de interesse.
- Felizmente,
as enzimas, em geral, proporcionam reações únicas e essa característica pode
ser usada para quantificá-las. Se uma enzima catalisa uma dada reação, como
ilustrado abaixo, pode-se assumir que a quantidade de produto formado ou de
substrato consumido será proporcional a quantidade de enzima presente na
solução.
E +
S D ES D E + P, onde:
E =
enzima; S = substrato; P = produto
- Como
sabemos, a partir de estudos prévios sobre a cinética enzimática, a velocidade de conversão de um substrato depende da
concentração do substrato presente na reação.
- Para
um excesso de S no meio reacional, a velocidade dessa reação é determinada pela
segunda etapa, ou seja, pelo desproporcionamento do complexo ES, gerando a
enzima livre (E) e o produto da reação (P). Nessas condições, quantificar P é
uma forma eficiente e indireta de determinar quanto há de E em uma dada solução
(veja discussão detalhada sobre essa questão no item 5).
- Com
base nesse princípio, apresentado de forma simplificada, pode-se entender a
definição de atividade enzimática expressa com base na formação de um dado
produto de reação:
A
definição amplamente usada na literatura relaciona:
1 UI (unidade internacional de enzima), corresponde à formação de
1 micromol de P por minuto de reação
(pode-se
ainda definir a mesma unidade como: consumo de 1 micromol de substrato por
minuto)
- Essa
definição é que permite todos os estudos comparativos da enzimologia. Ou seja,
se queremos comparar, por exemplo, dois sistemas de fermentação distintos, que
produzem a mesma enzima extracelular, podemos simplesmente proceder à reação
mencionada anteriormente com um volume definido do meio fermentado que contém a
enzima. Feita a reação, medimos quanto de P foi formado em um intervalo de
tempo. Com isso em mãos, podemos expressar quanto há de enzima em cada caso em
UI/mL de meio fermentado. Obviamente o processo que gerar um maior número de
UI/mL é o que contém a maior quantidade da enzima de interesse.
- Uma
outra unidade para a atividade enzimática tem sido recomendada pela
"Enzyme Comission" que normaliza a nomenclatura e as definições no
campo da enzimologia. Essa unidade é o katal (abreviado como kat).
Nessa unidade, se expressa a conversão de um substrato em mol.s-1. Usualmente as conversões são da
ordem de nanomoles por segundo o que acarreta no uso freqüente da unidade como
nkat (nanomoles covertidos por segundo).
- Verifique quantos nkat equivalem a 1 UI.
- A
atividade enzimática é freqüentemente expressa com base em UI por alguma medida
de volume ou massa. Dessa forma é comum expressar a atividade em:
UI/volume de meio fermentado ou
volume de um extrato enzimático
UI/massa de um substrato (muito
freqüente em fermentações em meio sólido)
- A
expressão da atividade enzimática em UI/massa de proteína total existente na
solução é denominada de atividade específica. Essa medida é muito usada nos procedimentos de
purificação de enzimas, pois à medida que a solução vai sendo enriquecida na
enzima de interesse a atividade específica vai aumentando.
5. Métodos de determinação da atividade enzimática
- Para
determinar a atividade enzimática experimentalmente é necessário determinar a
conversão de um substrato em função do tempo de reação, já que a atividade é
expressa em UI ou kat e que ambas unidades refletem a conversão do substrato em
função do tempo.
- Uma
reação qualquer catalisada por uma enzima fornece dados que indicam que o consumo de substrato ou a formação do produto de reação
seguem uma tendência exponencial com o tempo de reação.
- A
interpretação desse dado mostra que, tanto o desaparecimento do substrato como
a formação do produto, estão "espelhados" e que uma função
exponencial poderia explicar a reação em função do tempo:
[S] =
[So] e-kt
onde: [S] = concentração do substrato num dado tempo
[So] = concentração incial do
substrato
k = constante de velocidade para uma
reação de pseudo-primeira ordem
t = tempo de reação
- A
velocidade dessa reação seria portanto:
v = - d[S]/dt = d[P]/dt =
k[So] e-kt
- Aqui nos deparamos com duas questões que são muito importantes na
determinação experimental da atividade enzimática:
1) Observa-se
que à medida que passa o tempo, a velocidade da reação diminui e isso seria
esperado, pois a concentração de substrato vai diminuindo e, também, na grande
maioria dos casos, porque o produto de reação inibe a própria catálise
enzimática (ou até mesmo desnatura a enzima dependendo do caso). Lembre aqui do
equilíbrio químico que está envolvido nessa reação. Isso implica que para
descrevermos a atividade enzimática, devemos sempre determinar a maior
velocidade da reação catalisada pela enzima, ou seja a tangente da curva
d[S]/dt (ou d[P]/dt) em função do tempo de reação que passa pelo t =0.
2) Como se observa na equação diferencial mostrada
anteriormente, a velocidade de reação deve depender da concentração do
substrato e essa dependência deveria ainda ser linear. No entanto, vimos
anteriormente que a velocidade de reação não é
linearmente proporcional a concentração do substrato. Essa aparente
contradição, foi tema de grande questionamento no passado e de forma
simplificada e qualitativa podemos entender o fenômeno como segue:
k1 k2
E +
S D ES D E + P,
onde:
E =
enzima; S = substrato; P = produto
- Se a
reação, para uma dada quantidade de enzima ocorre na presença de uma baixa
concentração de substrato, à medida que essa concentração vai aumentando se
espera que a velocidade da reação aumente proporcionalmente. Ou seja, a
constante de velocidade k1 é que determina a
velocidade de reação. No entanto, se há um excesso de substrato na reação,
pode-se assumir que toda a enzima disponível está na forma do complexo ES e
então a constante de velocidade k2 é que determina a
velocidade da reação. Nessas condições é que se determina a velocidade máxima
de reação catalisada por uma enzima.
Portanto,
as duas questões apresentadas anteriormente, são resolvidas em termos
experimentais realizando as determinações de atividade em elevadas
concentrações de substrato e determinando a tangente da curva de conversão em
função do tempo. A determinação dessa tangente pode ser graficamente difícil e,
usualmente, busca-se condições experimentais que permitam obter ao menos 3 ou 4
pontos na curva [S] ou [P] versus t ainda dentro de uma
reta, cuja inclinação fornece a velocidade inicial máxima da reação.
Aspectos práticos da determinação de atividades enzimáticas (acesse aqui um compêndio sobre o tema)
(acesse aqui um exemplo de determinação de atividade a
partir de dados experimentais)
6. Aplicação de enzimas
Bibliografia
recomendada:
Industrial Enzimology, Godfrey T. e West S (eds),
1996
- Nesse tópico
discutiremos alguns exemplos de enzimas que encontram aplicação industrial. São
exemplos tomados da literatura e o objetivo aqui é simplesmente apresentar alguns
segmentos industriais que já fazem uso de enzimas em grande escala. Para isso
discutiremos alguns capítulos do livro Industrial Enzymology (Godfrey &
West, 1996).
a) Aplicação de enzimas na indústria dos detergentes (cap.
2.10)
b) Aplicação de enzimas no processamento de amido (Cap
2.20)
c) Aplicação de enzimas na indústria têxtil (cap 2.21)
d) Aplicação de enzimas na biotransformação de produtos químicos
(cap2.8)
e) Enzimas usadas
na conversão de materiais lignocelulósicos
7. Aulas práticas (05 grupos de experimentos e 05
relatórios) Note que para os experimentos 3 e 3.1 se requer somente 1
relatório.
1) Projeto de purificação de enzimas via
software. Cada grupo receberá uma mistura problema e deverá apresentar 2
seqüências lógicas de purificação com os respectivos resultados e sua discussão
(01 aula – 04 horas)
2)
Calibração de uma coluna cromatográfica e determinação da massa molar de
proteína desconhecida (02 aulas - 06 horas)
3) Produção de invertase por Saccharomyces cereviseae,
recuperação da enzima a partir do meio fermentado e determinação de sua
atividade (01 aula – 4 horas)
3.1) Efeito do pH e da temperatura sobre a atividade de
invertases produzidas por Saccharomyces cereviseae (02 aulas – 06 horas)
4) Extração
e uso de amilases do malte no processamento do amido (01 aula - 4 horas)
5) Projeto de extração e determinação de
enzimas envolvidas na conversão de biomassa lenhosa produzidas por fermentação
em meio sólido (03 aulas – 10 horas)